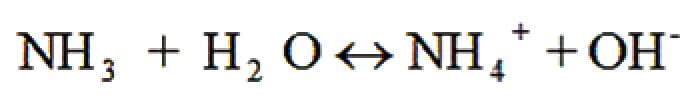En la primera parte de este artículo, se vieron las causas de estas variaciones; mencionándose entre ellas, los aportes de nitrógeno provenientes de los vertidos urbanos; así como, el uso creciente de fertilizantes y la ganadería. El aumento de la actividad acuícola también contribuye con estas variaciones. En esta parte del artículo, revisamos las formas de cómo el nitrógeno se reduce y alternativas para equilibrarlo en la piscina.
Presencia del nitrógeno en la piscina
El nitrógeno lo encontramos en forma de: nitrógeno orgánico, nitrógeno amoniacal, nitratos (NO3) y amonio (NH4+). El orgánico, en condiciones normales, proviene de organismos en descomposición. Representa el 83% del nitrógeno total del suelo; y para que las algas puedan aprovecharlo, éste debe ser primero transformado en nitrógeno inorgánico (mineralizado). El nitrógeno amoniacal, se encuentra retenido en las arcillas del suelo y es lentamente aprovechado por las algas. El nitrato (NO3-) y amonio (NH4+), son las formas aprovechables inmediatas.
¿Cómo se reduce el nitrógeno de la piscina?
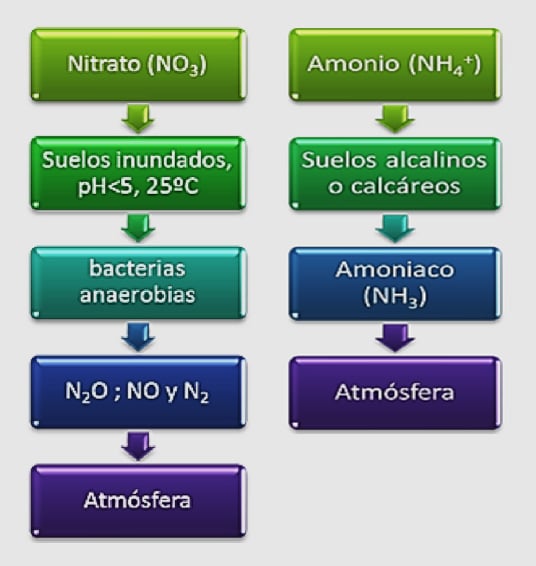
El ión amonio (NH4+) puede atarse a las partículas de arcilla y permanecer en el suelo; a diferencia del ión nitrato (NO3-), que es drenado con facilidad.
Por escorrentía superficial
Dado que la mayor parte de nitrógeno del suelo se concentra en las capas superiores; este nutriente se escurre fácilmente con el agua en los recambios sucesivos, o por la agitación de los aireadores mecánicos.
Por volatilización
Los óxidos de nitrógeno y el amoníaco son gases incoloros, poco solubles en agua y volátiles.
Por lixiviación
Los nitratos, por ser muy móviles y no ser retenidos por la arcilla, se pierden fácilmente en los recambios y en las pescas o lavados del fondo. El amonio, también se pierde en estos procesos; o cuando, las precipitaciones son intensas y prolongadas.
Procesos biológicos en el control del nitrógeno
En el manejo de una piscina siempre se considera el control de sólidos suspendidos, patógenos y materia orgánica. Actualmente, hay también interés en la remoción del nitrógeno; debido a, sus efectos sobre el crustáceo y las consecuencias ambientales que trae. La transformación de los compuestos nitrogenados se hace mediante procesos biológicos; así como, la asimilación de las algas, la amonificación y la nitrificación.
En este artículo, se dan opciones para transformar o remover los compuestos nitrogenados de las piscinas; ponderando las formas que permiten removerlo, sin trasladarlo a las camaroneras vecinas.
El amonio se acumula en el fango de la piscina bajo condiciones anóxicas; y puede, transformarse en nitratos bajo ambientes oxigenados. Por esta razón, es bueno mantener siempre el OD con valores ≥3.5ppm. Con esta concentración; como mínimo, se asume que estamos cubriendo el oxígeno necesario para la respiración del camarón y la de los microorganismos a cargo de estas transformaciones. También se necesita oxígeno para cubrir las reacciones químicas de oxidación de la materia orgánica (DQO) que se da en el agua y suelo de la piscina. Es de gran ayuda, remover el suelo durante su preparación, para oxigenarlo y descontaminarlo.
El amonio total es la suma del amonio no ionizado o amoníaco (NH3) y el amonio ionizado (NH4+). En el agua, ambas estructuras establecen un equilibrio mediante la siguiente reacción:
Este equilibrio depende de la temperatura, el pH y la salinidad. A 25°C y un pH ≥ 7, el amonio no ionizado representa alrededor del 0,1% del amonio total; pero, si el pH sube a 9,5 y la temperatura es de 30°C, dicho porcentaje puede llegar a niveles tóxicos. Entonces, para evitar estos riesgos, es necesario mantener estas variables en rangos óptimos. Un rango sugerido para el nitrógeno en el agua sería de 0.2 a 05 ppm. Si el valor cae por debajo de 0.2, habrá que revisar la fertilización.
La forma no ionizada del amonio (NH3) es muy tóxica; debido a su facilidad para moverse a través de las membranas branquiales. Esta toxicidad empeora cuando el OD tiende a la baja y la temperatura sube. Tengamos presente que, los niveles altos de NH3, pueden presentarse con facilidad en sistemas de cultivo intensivos o súper intensivos; donde la calidad del agua es asunto de mucho cuidado; dado a la acumulación de los alimentos sobrantes, algas muertas y las heces.
El nitrito también tiene efectos tóxicos sobre las especies acuáticas y conviene mantener valores menores a 0.1ppm. Pero la finalidad de controlar el amoníaco (NH3); también es, para determinar la eficacia del proceso nitrificación / desnitrificación. Las bacterias transforman el nitrógeno a productos finales no contaminantes, como NO3 y N2.
Los procesos biológicos son económicamente viables, pero lentos; sin embargo, son muy efectivos y no trasladan el contaminante a la camaronera vecina. Para el reciclaje natural de los compuestos orgánicos en una piscina, es necesario promover el desarrollo de las poblaciones de bacterias heterotróficas desde el inicio del cultivo. Ellas son parte del ecosistema equilibrado de una camaronera.
La aplicación de zeolita mejora la calidad del agua a través del intercambio de sus cationes mono y divalentes con el amonio. La capacidad de absorción de amoníaco, de las zeolitas naturales, hace que sea una forma natural muy efectiva de controlar los altos niveles de amoníaco generados en este tipo de cultivos.